Per segnalare un effetto indesiderato o un reclamo su un prodotto Lilly, si prega di non utilizzare questo sito web. La segnalazione delle reazioni avverse è estremamente importante. Gli operatori sanitari e i pazienti possono riportare una reazione avversa o un reclamo di un prodotto sul sito di AIFA.
▼Mounjaro® (tirzepatide)
Mounjaro 2,5 mg soluzione iniettabile in penna preriempita
Mounjaro 5 mg soluzione iniettabile in penna preriempita
Mounjaro 7,5 mg soluzione iniettabile in penna preriempita
Mounjaro 10 mg soluzione iniettabile in penna preriempita
Mounjaro 12,5 mg soluzione iniettabile in penna preriempita
Mounjaro 15 mg soluzione iniettabile in penna preriempita
Mounjaro 2,5 mg soluzione iniettabile in flaconcino
Mounjaro 5 mg soluzione iniettabile in flaconcino
Mounjaro 7,5 mg soluzione iniettabile in flaconcino
Mounjaro 10 mg soluzione iniettabile in flaconcino
Mounjaro 12,5 mg soluzione iniettabile in flaconcino
Mounjaro 15 mg soluzione iniettabile in flaconcino
Mounjaro 2,5 mg/dose KwikPen soluzione iniettabile in penna preriempita
Mounjaro 5 mg/dose KwikPen soluzione iniettabile in penna preriempita
Mounjaro 7,5 mg/dose KwikPen soluzione iniettabile in penna preriempita
Mounjaro 10 mg/dose KwikPen soluzione iniettabile in penna preriempita
Mounjaro 12,5 mg/dose KwikPen soluzione iniettabile in penna preriempita
Mounjaro 15 mg/dose KwikPen soluzione iniettabile in penna preriempita
Penna preriempita, monodose
Mounjaro 2,5 mg soluzione iniettabile in penna preriempita
Ogni penna preriempita contiene 2,5 mg di tirzepatide in 0,5 mL di soluzione (5 mg/mL).
Mounjaro 5 mg soluzione iniettabile in penna preriempita
Ogni penna preriempita contiene 5 mg di tirzepatide in 0,5 mL di soluzione (10 m/mL).
Mounjaro 7,5 mg soluzione iniettabile in penna preriempita
Ogni penna preriempita contiene 7,5 mg di tirzepatide in 0,5 mL di soluzione (15 mg/mL).
Mounjaro 10 mg soluzione iniettabile in penna preriempita
Ogni penna preriempita contiene 10 mg di tirzepatide in 0,5 mL di soluzione (20 mg/mL).
Mounjaro 12,5 mg soluzione iniettabile in penna preriempita
Ogni penna preriempita contiene 12,5 mg di tirzepatide in 0,5 mL di soluzione (25 mg/mL).
Mounjaro 15 mg soluzione iniettabile in penna preriempita
Ogni penna preriempita contiene 15 mg di tirzepatide in 0,5 mL di soluzione (30 mg/mL).
Flaconcino, monodose
Mounjaro 2,5 mg soluzione iniettabile in flaconcino
Ogni flaconcino contiene 2,5 mg di tirzepatide in 0,5 mL di soluzione (5 mg/mL).
Mounjaro 5 mg soluzione iniettabile in flaconcino
Ogni flaconcino contiene 5 mg di tirzepatide in 0,5 mL di soluzione (10 mg/mL).
Mounjaro 7,5 mg soluzione iniettabile in flaconcino
Ogni flaconcino contiene 7,5 mg di tirzepatide in 0,5 mL di soluzione (15 mg/mL).
Mounjaro 10 mg soluzione iniettabile in flaconcino
Ogni flaconcino contiene 10 mg di tirzepatide in 0,5 mL di soluzione (20 mg/mL).
Mounjaro 12,5 mg soluzione iniettabile in flaconcino
Ogni flaconcino contiene 12,5 mg di tirzepatide in 0,5 mL di soluzione (25 mg/mL).
Mounjaro 15 mg soluzione iniettabile in flaconcino
Ogni flaconcino contiene 15 mg di tirzepatide in 0,5 mL di soluzione (30 mg/mL).
Penna preriempita (KwikPen), multidose
Mounjaro 2,5 mg/dose KwikPen soluzione iniettabile in penna preriempita
Ogni dose contiene 2,5 mg di tirzepatide in 0,6 mL di soluzione. Ogni penna preriempita multidose contiene 10 mg di tirzepatide in 2,4 mL (4,17 mg/mL). Ogni penna rilascia 4 dosi da 2,5 mg.
Mounjaro 5 mg/dose KwikPen soluzione iniettabile in penna preriempita
Ogni dose contiene 5 mg di tirzepatide in 0,6 mL di soluzione. Ogni penna preriempita multidose contiene 20 mg di tirzepatide in 2,4 mL (8,33 mg/mL). Ogni penna rilascia 4 dosi da 5 mg.
Mounjaro 7,5 mg/dose KwikPen soluzione iniettabile in penna preriempita
Ogni dose contiene 7,5 mg di tirzepatide in 0,6 mL di soluzione. Ogni penna preriempita multidose contiene 30 mg di tirzepatide in 2,4 mL (12,5 mg/mL). Ogni penna rilascia 4 dosi da 7,5 mg.
Mounjaro 10 mg/dose KwikPen soluzione iniettabile in penna preriempita
Ogni dose contiene 10 mg di tirzepatide in 0,6 mL di soluzione. Ogni penna preriempita multidose contiene 40 mg di tirzepatide in 2,4 mL (16,7 mg/mL). Ogni penna rilascia 4 dosi da 10 mg.
Mounjaro 12,5 mg/dose KwikPen soluzione iniettabile in penna preriempita
Ogni dose contiene 12,5 mg di tirzepatide in 0,6 mL di soluzione. Ogni penna preriempita multidose contiene 50 mg di tirzepatide in 2,4 mL (20,8 mg/mL). Ogni penna rilascia 4 dosi da 12.5 mg.
Mounjaro 15 mg/dose KwikPen soluzione iniettabile in penna preriempita
Ogni dose contiene 15 mg di tirzepatide in 0,6 mL di soluzione. Ogni penna preriempita multidose contiene 60 mg di tirzepatide in 2,4 mL (25 mg/mL). Ogni penna rilascia 4 dosi da 15 mg.
Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
Soluzione iniettabile (iniezione).
Soluzione limpida, da incolore a leggermente gialla.
4.1 Indicazioni terapeutiche
Diabete mellito di tipo 2
Mounjaro è indicato per il trattamento di adulti affetti da diabete mellito di tipo 2 non adeguatamente controllato in aggiunta alla dieta e all’esercizio fisico:
• come monoterapia quando l’uso di metformina è considerato inappropriato a causa di intolleranza o controindicazioni
• in aggiunta ad altri medicinali per il trattamento del diabete.
Per i risultati degli studi clinici rispetto alle associazioni, agli effetti sul controllo glicemico e alle popolazioni studiate, vedere i paragrafi 4.4, 4.5 e 5.1.
Gestione del peso corporeo
Mounjaro è indicato in aggiunta a una dieta povera di calorie e ad un aumento dell’attività fisica per la gestione del peso corporeo, inclusi la riduzione del peso e il mantenimento del peso, in pazienti adulti con un indice di massa corporea (IMC) iniziale di
• ≥30 kg/m2 (obesità), o
• da ≥ 27 kg/m2 a < 30 kg/m2 (sovrappeso) in presenza di almeno una co-morbidità correlata al peso (ad esempio ipertensione, dislipidemia, apnea ostruttiva del sonno, malattia
cardiovascolare, prediabete o diabete mellito di tipo 2).
Per i risultati degli studi clinici relativi all’apnea ostruttiva del sonno (OSA), vedere il paragrafo 5.1.
4.2 Posologia e modo di somministrazione
Posologia
La dose iniziale di tirzepatide è 2,5 mg una volta a settimana. Dopo 4 settimane, la dose deve essere aumentata a 5 mg una volta a settimana. Se necessario, è possibile aumentare la dose con incrementi di 2,5 mg dopo un minimo di 4 settimane con la dose in uso.
Le dosi di mantenimento raccomandate sono 5 mg, 10 mg e 15 mg.
La dose massima è 15 mg una volta a settimana.
Quando tirzepatide viene aggiunto alla terapia esistente con metformina e/o inibitore del co-trasportatore di sodio-glucosio 2 (SGLT2i), può essere mantenuta la dose in uso di metformina e/o SGLT2i.
Quando tirzepatide viene aggiunto alla terapia esistente con una sulfonilurea e/o insulina, si può considerare una riduzione della dose di sulfonilurea o insulina per ridurre il rischio di ipoglicemia. L’automonitoraggio della glicemia è necessario per aggiustare la dose di sulfonilurea e insulina. Si raccomanda un approccio graduale per la riduzione dell’insulina. (vedere paragrafi 4.4 e 4.8).
Dosi dimenticate
Se viene dimenticata una dose, deve essere somministrata il prima possibile entro 4 giorni dalla dose dimenticata. Se sono trascorsi più di 4 giorni, saltare la dose dimenticata e somministrare la dose successiva nel giorno regolarmente programmato. In ogni caso, i pazienti possono poi riprendere la loro regolare programmazione una volta a settimana.
Modifica del giorno programmato per la somministrazione
Il giorno di somministrazione settimanale può essere modificato, se necessario, purché l’intervallo tra le due somministrazioni sia di almeno 3 giorni.
Popolazioni particolari
Anziani, genere, popolazione, etnia o peso corporeo
Non è necessario modificare la dose in base all’età, al genere, alla popolazione, all’etnia o al peso corporeo (vedere paragrafi 5.1 e 5.2). Sono disponibili solo dati molto limitati su pazienti di età ≥ 85 anni.
Compromissione renale
Non è richiesto alcun aggiustamento della dose per i pazienti con compromissione renale, compresa la malattia renale allo stadio terminale (end stage renal disease, ESRD). L’esperienza con l’uso di tirzepatide in pazienti con compromissione renale severa e ESRD è limitata. Prestare attenzione quando si trattano questi pazienti con tirzepatide (vedere paragrafo 5.2).
Compromissione epatica
Non è richiesto alcun aggiustamento della dose per i pazienti con compromissione epatica.
L’esperienza con l’uso di tirzepatide in pazienti con compromissione epatica severa è limitata. Prestare attenzione quando si trattano questi pazienti con tirzepatide (vedere paragrafo 5.2).
Popolazione pediatrica
La sicurezza e l’efficacia di tirzepatide nei bambini di età inferiore a 18 anni non sono state ancora stabilite. Non ci sono dati disponibili.
Modo di somministrazione
Mounjaro deve essere iniettato per via sottocutanea nell’addome, nella coscia o nella parte superiore del braccio.
La dose può essere somministrata in qualsiasi momento della giornata, indipendentemente dai pasti.
I siti di iniezione devono essere ruotati ad ogni dose. Se un paziente si inietta anche insulina, deve iniettarsi Mounjaro in un sito di iniezione diverso.
I pazienti devono essere avvisati di leggere attentamente le istruzioni per l’uso incluse nel foglio illustrativo prima di somministrare il medicinale.
Flaconcino
I pazienti e le persone che si prendono cura di loro devono essere istruiti alla tecnica di iniezione sottocutanea prima di somministrare Mounjaro.
Per ulteriori informazioni prima della somministrazione, vedere il paragrafo 6.6.
4.3 Controindicazioni
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
4.4 Avvertenze speciali e precauzioni d’impiego
Pancreatite acuta
Tirzepatide non è stato studiato in pazienti con una storia di pancreatite e deve essere usato con cautela in questi pazienti.
Pancreatite acuta è stata segnalata nei pazienti trattati con tirzepatide.
I pazienti devono essere informati dei sintomi della pancreatite acuta. Se si sospetta una pancreatite, la somministrazione di tirzepatide deve essere interrotta. Se viene confermata la diagnosi di pancreatite, la terapia con tirzepatide non deve essere ripresa. In assenza di altri segni e sintomi di pancreatite acuta, gli aumenti degli enzimi pancreatici da soli non sono predittivi di pancreatite acuta (vedere paragrafo 4.8).
Ipoglicemia
I pazienti che ricevono tirzepatide in associazione con un insulino-secretagogo (ad esempio una sulfonilurea) o con insulina possono avere un rischio aumentato di ipoglicemia. Il rischio di ipoglicemia può essere ridotto riducendo la dose dell’insulino-secretagogo o dell’insulina (vedere paragrafi 4.2 e 4.8).
Effetti gastrointestinali
Tirzepatide è stato associato a reazioni avverse gastrointestinali, che includono nausea, vomito e diarrea (vedere paragrafo 4.8). Queste reazioni avverse possono portare a disidratazione, che potrebbe portare a un deterioramento della funzione renale inclusa compromissione renale acuta. I pazienti trattati con tirzepatide devono essere informati del potenziale rischio di disidratazione, dovuta alle reazioni avverse gastrointestinali e devono prendere precauzioni per evitare perdita di liquidi e alterazioni degli elettroliti. Questo deve essere preso in considerazione in particolare negli anziani, che possono essere più suscettibili a tali complicazioni.
Patologia gastrointestinale severa
Tirzepatide non è stato studiato in pazienti affetti da patologia gastrointestinale severa, inclusa gastroparesi severa, e deve essere usato con cautela in questi pazienti.
Retinopatia diabetica
Tirzepatide non è stato studiato in pazienti con retinopatia diabetica non proliferativa che richiede una terapia acuta, retinopatia diabetica proliferativa o edema maculare diabetico e deve essere usato con cautela in questi pazienti, monitorandoli adeguatamente.
Aspirazione in associazione con anestesia generale o sedazione profonda
Sono stati segnalati casi di aspirazione polmonare in pazienti trattati con agonisti del recettore GLP-1sottoposti ad anestesia generale o sedazione profonda. Pertanto, prima di eseguire procedure conanestesia generale o sedazione profonda, deve essere considerato il rischio aumentato di contenutogastrico residuo dovuto a svuotamento gastrico ritardato (vedere paragrafo 4.8).
Contenuto di sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, cioè essenzialmente “senza sodio”.
Alcol benzilico
Questo medicinale contiene 5,4 mg di alcol benzilico per ogni dose di 0,6 mL di Mounjaro KwikPen
4.5 Interazioni con altri medicinali ed altre forme d’interazione
Tirzepatide ritarda lo svuotamento gastrico e quindi ha il potenziale di influenzare il tasso di assorbimento dei medicinali orali somministrati in concomitanza. Questo effetto, che determina una diminuzione della Cmax e un tmax ritardato, è più pronunciato all’inizio del trattamento con tirzepatide. Sulla base dei risultati di uno studio con paracetamolo, che è stato utilizzato come medicinale modello per valutare l’effetto di tirzepatide sullo svuotamento gastrico, non si prevede che siano necessari aggiustamenti della dose per la maggior parte dei medicinali orali somministrati in concomitanza. Tuttavia, si raccomanda di monitorare i pazienti che assumono medicinali orali con un indice terapeutico ristretto (ad esempio warfarin, digossina), specialmente all’inizio del trattamento con tirzepatide e dopo l’aumento della dose. Il rischio di un effetto ritardato deve essere preso in considerazione anche per i medicinali orali per i quali è importante una rapida insorgenza dell’effetto.
Paracetamolo
Dopo una dose singola di 5 mg di tirzepatide, la concentrazione plasmatica massima (Cmax) di paracetamolo è stata ridotta del 50 % e il tempo mediano (tmax) per raggiungere la Cmax è stato ritardato di 1 ora. L’effetto di tirzepatide sull’assorbimento orale di paracetamolo dipende dalla dose e dal tempo. A basse dosi (0,5 e 1,5 mg), c’era solo un lieve cambiamento nell’esposizione al paracetamolo. Dopo quattro dosi settimanali consecutive di tirzepatide (5/5/8/10 mg), non è stato osservato alcun effetto sulla Cmax e tmax di paracetamolo. L’esposizione complessiva (AUC) non è stata influenzata. Non è necessario alcun aggiustamento della dose di paracetamolo quando somministrato con tirzepatide.
Contraccettivi orali
La somministrazione di un contraccettivo orale combinato (0,035 mg di etinilestradiolo più 0,25 mg di norgestimato, un profarmaco della norelgestromina) in presenza di una singola dose di tirzepatide (5 mg) ha determinato una riduzione della Cmax e dell’area sotto la curva (AUC) del contraccettivo orale. La Cmax dell’etinilestradiolo è stata ridotta del 59 % e l’AUC del 20 % con un ritardo del tmax di 4 ore. La Cmax della norelgestromina è stata ridotta del 55 % e l’AUC del 23 % con un ritardo del tmax di 4,5 ore. La Cmax di norgestimato è stata ridotta del 66 % e l’AUC del 20 % con un ritardo del tmax di 2,5 ore. Questa riduzione dell’esposizione dopo una singola dose di tirzepatide non è considerata clinicamente rilevante. Non è richiesto alcun aggiustamento della dose dei contraccettivi orali.
4.6 Fertilità, gravidanza e allattamento
Donne in età fertile
Si raccomanda alle donne in età fertile di usare misure contraccettive durante il trattamento con tirzepatide.
Gravidanza
I dati relativi all’uso di tirzepatide in donne in gravidanza non esistono o sono in numero limitato. Gli studi sugli animali hanno evidenziato una tossicità riproduttiva (vedere paragrafo 5.3). Tirzepatide non è raccomandato durante la gravidanza e nelle donne in età fertile che non usano misure contraccettive. Se una paziente desidera una gravidanza o si verifica una gravidanza, tirzepatide deve essere interrotto. Tirzepatide deve essere interrotto almeno 1 mese prima di una gravidanza pianificata a causa della lunga emivita (vedere paragrafo 5.2).
Allattamento
Non è noto se tirzepatide sia escreto nel latte umano. Non può essere escluso un rischio per il neonato/lattante.
Si deve decidere se interrompere l’allattamento o interrompere la terapia/astenersi dalla terapia con tirzepatide tenendo in considerazione il beneficio dell’allattamento per il bambino e il beneficio della terapia per la donna.
Fertilità
L’effetto di tirzepatide sulla fertilità nell’uomo non è noto.
Gli studi sugli animali con tirzepatide non hanno indicato effetti dannosi diretti sulla fertilità (vedere paragrafo 5.3).
4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
Tirzepatide non altera o altera in modo trascurabile la capacità di guidare o di usare macchinari. Quando tirzepatide è usato in associazione con una sulfonilurea o insulina, i pazienti devono essere avvisati di prendere precauzioni per evitare l’ipoglicemia durante la guida e l’uso di macchinari (vedere paragrafo 4.4).
4.8 Effetti indesiderati
Riassunto del profilo di sicurezza
In 12 studi di fase 3 completati, 8 158 pazienti sono stati esposti a tirzepatide da solo o in associazione con altri medicinali ipoglicemizzanti. Le reazioni avverse riportate più frequentemente sono state disturbi gastrointestinali e questi sono stati per lo più di gravità lieve o moderata. L’incidenza di nausea, diarrea e vomito è stata maggiore durante il periodo di aumento della dose ed è diminuita nel tempo. (vedere paragrafi 4.2 e 4.4).
Tabella delle reazioni avverse
Le seguenti reazioni avverse riportate negli studi clinici sono elencate di seguito in base alla classificazione per sistemi e organi e in ordine di incidenza decrescente (molto comune: ≥ 1/10; comune: ≥ 1/100, < 1/10; non comune: ≥ 1/1 000, < 1/100; raro: ≥ 1/10 000, < 1/1 000; molto raro: < 1/10 000). All’interno di ciascun gruppo di incidenza, le reazioni avverse sono presentate in ordine decrescente di frequenza.
Tabella 1. Reazioni avverse


#Da segnalazioni post-marketing
*Ipoglicemia definita di seguito.
†Stanchezza include i termini stanchezza, astenia, malessere e letargia.
1Reazioni avverse che si applicano solo a pazienti con diabete mellito di tipo 2.
2 Reazioni avverse che si applicano principalmente a pazienti con sovrappeso o obesità, con o senzadiabete mellito di tipo 2.
3 La frequenza è stata molto comune negli studi clinici sulla gestione del peso corporeo e sull’OSA e
comune negli studi clinici sul diabete mellito di tipo 2.
4 La frequenza è stata comune negli studi clinici sulla gestione del peso corporeo e sull’OSA e non
comune negli studi clinici sul diabete mellito di tipo 2.
Descrizione di reazioni avverse selezionate
Reazioni di ipersensibilità
Reazioni di ipersensibilità sono state riportate con tirzepatide nel pool di studi clinici per il diabete mellito di tipo 2, controllati con placebo, a volte gravi (ad esempio orticaria ed eczema); reazioni di ipersensibilità sono state riportate nel 3,2 % dei pazienti trattati con tirzepatide rispetto all’1,7 % dei pazienti trattati con placebo. Dopo la commercializzazione di tirzepatide sono stati riportati raramente casi di reazione anafilattica e angioedema.
Reazioni di ipersensibilità, talvolta gravi (ad es. eruzione cutanea e dermatite), sono state riportate con tirzepatide in un pool di 3 studi clinici sulla gestione del peso corporeo controllati con placebo e in un pool di 2 studi clinici sull’OSA controllati con placebo; reazioni di ipersensibilità sono state riportate nel 3,0 - 5,0 % dei pazienti trattati con tirzepatide rispetto al 2,1 - 3,8 % dei pazienti trattati con placebo.
Ipoglicemia in pazienti con diabete mellito di tipo 2
Studi clinici sul diabete mellito di tipo 2
Ipoglicemia clinicamente significativa (glucosio ematico < 3,0 mmol/L (< 54 mg/dL)) o ipoglicemia severa (che richiede l’assistenza di un’altra persona) si è verificata nel 10 - 14 % dei pazienti (da 0,14 a 0,16 eventi/paziente/anno) quando tirzepatide è stato aggiunto a sulfonilurea e nel 14 - 19 % dei pazienti (da 0,43 a 0,64 eventi/paziente/anno) quando tirzepatide è stata aggiunta a insulina basale.
Il tasso di ipoglicemia clinicamente significativa quando tirzepatide è stata usata in monoterapia o quando è stata aggiunta ad altri medicinali antidiabetici orali è stato fino a 0,04 eventi/paziente anno (vedere tabella 1 e paragrafi 4.2, 4.4 e 5.1).
Negli studi clinici di fase 3, 10 (0,2 %) pazienti hanno riportato 12 episodi di ipoglicemia severa. Di questi 10 pazienti, 5 (0,1 %) erano trattati in associazione con insulina glargine o sulfonilurea e hanno riportato 1 episodio ciascuno.
Studi clinici sulla gestione del peso corporeo
In uno studio di fase 3 sulla gestione del peso corporeo, controllato con placebo, in pazienti con diabete di tipo 2, l’ipoglicemia (glicemia < 3,0 mmol/L (< 54 mg/dL)) è stata riportata nel 4,2 % dei pazienti trattati con tirzepatide rispetto all’1,3 % dei pazienti trattati con placebo. In questo studio clinico, i pazienti che assumevano tirzepatide in associazione con un secretagogo dell'insulina (ad es. sulfonilurea) hanno avuto una maggiore incidenza di ipoglicemia (10,3 %) rispetto ai pazienti trattati con tirzepatide che non assumevano una sulfonilurea (2,1 %). Non sono stati riportati episodi di ipoglicemia severa.
Reazioni avverse gastrointestinali
Negli studi di fase 3 controllati con placebo per il diabete mellito di tipo 2, i disturbi gastrointestinali sono aumentati in modo dose-dipendente con tirzepatide 5 mg (37,1 %), 10 mg (39,6 %) e 15 mg (43,6 %) rispetto al placebo (20,4 %). Con tirzepatide 5 mg, 10 mg e 15 mg, nausea si è verificata nel 12,2 %, 15,4 % e 18,3 % rispetto al 4,3 % con placebo e diarrea nell’11,8 %, 13,3 % e 16,2 % rispetto all’8,9 % con placebo. Le reazioni avverse gastrointestinali sono state per lo più di entità lieve (74 %) o moderata (23,3 %). L’incidenza di nausea, vomito e diarrea è stata maggiore durante il periodo di aumento della dose ed è diminuita nel tempo.
Più pazienti nei gruppi tirzepatide 5 mg (3,0 %), 10 mg (5,4 %) e 15 mg (6,6 %) rispetto al gruppo placebo (0,4 %) hanno interrotto definitivamente la terapia a causa di un evento gastrointestinale.
In uno studio di fase 3 sulla gestione del peso corporeo, controllato con placebo, in pazienti senza diabete mellito di tipo 2, i disturbi gastrointestinali sono aumentati con tirzepatide 5 mg (55,6 %), 10 mg (60,8 %) e 15 mg (59,2 %) rispetto al placebo (30,3 %). Nausea si è verificata nel 24,6 %, 33,3 % e 31,0 % rispetto al 9,5 % e diarrea nel 18,7 %, 21,2 % e 23,0 % rispetto al 7,3 %, rispettivamente, con tirzepatide 5 mg, 10 mg e 15 mg rispetto al placebo. Le reazioni avverse gastrointestinali sono state per lo più di entità lieve (60,8 %) o moderata (34,6 %). L’incidenza di nausea, vomito e diarrea è stata maggiore durante il periodo di aumento della dose ed è diminuita nel tempo.
Più pazienti nei gruppi tirzepatide 5 mg (1,9 %), 10 mg (4,4 %) e 15 mg (4,1 %) rispetto al gruppo placebo (0,5 %) hanno interrotto definitivamente il trattamento durante lo studio clinico a causa di un evento gastrointestinale.
Eventi correlati alla colecisti
In un pool di 3 studi di fase 3 sulla gestione del peso corporeo, controllati con placebo, l’incidenza complessiva di colecistite e colecistite acuta è stata dello 0,6 % e 0,2 % rispettivamente nei pazienti trattati con tirzepatide e placebo.
In un pool di 3 studi di fase 3 sulla gestione del peso corporeo controllati con placebo e in un pool di 2 studi di fase 3 sull’OSA controllati con placebo, colecistite acuta è stata riportata al massimo nel 2,0 % dei pazienti trattati con tirzepatide e al massimo nell’1,6 % dei pazienti trattati con placebo.
Negli studi di fase 3 sulla gestione del peso corporeo, gli eventi acuti della colecisti sono stati positivamente associati alla riduzione del peso.
Immunogenicità
Non vi è stata evidenza di un profilo farmacocinetico alterato o di un impatto sull’efficacia di tirzepatide associati allo sviluppo di anticorpi anti-farmaco (anti-drug antibodies, ADA) o di anticorpi neutralizzanti.
Negli studi clinici di fase 3 per il diabete mellito di tipo 2 sono stati valutati 5 025 pazienti trattati con tirzepatide per gli ADA. Di questi, il 51,1 % ha sviluppato ADA correlati al trattamento (treatment-emergent, TE) durante il periodo di terapia. Nel 38,3 % dei pazienti valutati, gli ADA TE sono stati persistenti (cioè ADA TE sono stati presenti per un periodo di 16 settimane o più). L’1,9 % e il 2,1 % hanno sviluppato anticorpi neutralizzanti rispettivamente contro l’attività di tirzepatide sui recettori del polipeptide insulinotropico glucosio-dipendente (GIP) e del peptide 1 simile a glucagone (GLP-1), e lo 0,9 % e lo 0,4 % hanno sviluppato anticorpi neutralizzanti rispettivamente contro il GIP nativo e il GLP-1 nativo.
Nei 4 studi di fase 3 sulla gestione del peso corporeo e nei 2 studi di fase 3 sull’OSA sono stati valutati 3 710 pazienti trattati con tirzepatide per gli ADA. Di questi, il 60,6 – 65,1 % ha sviluppato ADA TE durante il periodo di trattamento. Nel 46,5 – 51,3 % dei pazienti valutati, gli ADA TE sono stati persistenti. Fino al 2,3 % e 2,3 % dei pazienti hanno sviluppato anticorpi neutralizzanti, rispettivamente, contro l’attività di tirzepatide sui recettori del GIP e del GLP-1, e fino allo 0,7 % e 0,1 % hanno sviluppato anticorpi neutralizzanti, ispettivamente, contro il GIP nativo e il GLP-1 nativo.
Frequenza cardiaca
Negli studi di fase 3 controllati con placebo in pazienti con diabete mellito di tipo 2, il trattamento con tirzepatide ha determinato un aumento medio della frequenza cardiaca da 3 a 5 battiti al minuto (bpm). L’aumento medio massimo della frequenza cardiaca nei pazienti trattati con placebo è stato di 1 battito al minuto.
La percentuale dei pazienti che hanno avuto una variazione della frequenza cardiaca basale > 20 bpm in 2 o più visite consecutive è stata del 2,1 %, 3,8 % e 2,9 %, rispettivamente con tirzepatide 5 mg, 10 mg e 15 mg, rispetto al 2,1 % con placebo.
Piccoli aumenti medi dell’intervallo PR sono stati osservati con tirzepatide rispetto a placebo
(aumento medio rispettivamente da 1,4 a 3,2 msec e diminuzione media di 1,4 msec). Non sono state osservate differenze negli episodi di aritmia e disturbi della conduzione cardiaca correlati al trattamento tra tirzepatide 5 mg, 10 mg, 15 mg e placebo (rispettivamente 3,8 %, 2,1 %, 3,7 % e 3 %).
Nei 3 studi di fase 3 sulla gestione del peso corporeo, controllati con placebo, il trattamento con tirzepatide ha determinato un aumento medio della frequenza cardiaca di 3 battiti al minuto. Non c'è stato alcun aumento medio della frequenza cardiaca nei pazienti trattati con placebo.
In uno studio sulla gestione del peso corporeo, controllato con placebo, in pazienti senza diabete mellito di tipo 2, la percentuale dei pazienti che hanno avuto una variazione della frequenza cardiaca basale > 20 bpm in 2 o più visite consecutive è stata del 2,4 %, 4,9 % e 6,3 %, rispettivamente con tirzepatide 5 mg, 10 mg e 15 mg, rispetto all’1,2 % con placebo.
Piccoli aumenti medi dell’intervallo PR sono stati osservati con tirzepatide e placebo (aumento medio, rispettivamente, da 0,3 a 1,4 msec e di 0,5 msec). Non sono state osservate differenze negli episodi di aritmia e disturbi della conduzione cardiaca correlati al trattamento tra tirzepatide 5 mg, 10 mg, 15 mg e placebo (rispettivamente 3,7 %, 3,3 %, 3,3 % e 3,6 %).
Reazioni in sede di iniezione
Negli studi di fase 3 controllati con placebo per il diabete mellito di tipo 2, le reazioni in sede di iniezione sono aumentate con tirzepatide (3,2 %) rispetto a placebo (0,4 %).
Nei 3 studi di fase 3 sulla gestione del peso corporeo, controllati con placebo e nei 2 studi di fase 3 sull’OSA, controllati con placebo, le reazioni in sede di iniezione sono aumentate con tirzepatide (8,0 – 8,6 %) rispetto a placebo (1,8 – 2,6 %).
Complessivamente, negli studi di fase 3, i segni e i sintomi più comuni delle reazioni in sede di iniezione sono stati eritema e prurito. L’entità massima delle reazioni in sede di iniezione per i pazienti è stata lieve (91 %) o moderata (9 %). Nessuna reazione in sede di iniezione è stata grave.
Enzimi pancreatici
Negli studi di fase 3 controllati con placebo per il diabete mellito di tipo 2, il trattamento con tirzepatide ha determinato un aumento medio rispetto al basale dell’amilasi pancreatica dal 33 % al 38 % e della lipasi dal 31 % al 42 %. I pazienti trattati con placebo hanno avuto un aumento rispetto al basale del 4 % dell’amilasi e non sono state osservate variazioni della lipasi.
Nei 3 studi di fase 3 sulla gestione del peso corporeo, controllati con placebo e nei 2 studi di fase 3 sull’OSA, controllati con placebo, il trattamento con tirzepatide ha determinato un aumento medio rispetto al basale del 23 – 24,6 % dell’amilasi pancreatica e del 34 – 39 % della lipasi. I pazienti trattati con placebo hanno avuto un aumento rispetto al basale dello 0,7 – 1,8 % dell’amilasi e del 3,5 – 5,7 % della lipasi.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite l’Agenzia Italiana del Farmaco, Sito web: https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
4.9 Sovradosaggio
In caso di sovradosaggio, deve essere iniziato un trattamento di supporto appropriato in base ai segni e sintomi clinici del paziente. I pazienti possono manifestare reazioni avverse gastrointestinali inclusa ausea. Non esiste un antidoto specifico per il sovradosaggio di tirzepatide. Può essere necessario un periodo prolungato di osservazione e trattamento di questi sintomi, tenendo conto dell’emivita di tirzepatide (circa 5 giorni).
5.1 Proprietà farmacodinamiche
Categoria farmacoterapeutica: Medicinali usati nel diabete, ipoglicemizzanti, escluse le insuline, Codice ATC: A10BX16
Meccanismo d’azione
Tirzepatide è un agonista recettoriale a lunga durata d’azione del polipeptide insulinotropico glucosio-dipendente (GIP) e del peptide 1 simile a glucagone (GLP-1), altamente selettivo per i recettori del GIP e del GLP-1 umani. Tirzepatide ha un’elevata affinità per i recettori del GIP e del GLP-1. L’attività di tirzepatide sul recettore del GIP è simile all’ormone GIP nativo. L’attività di tirzepatide sul recettore del GLP-1 è inferiore rispetto all’ormone GLP-1 nativo. Entrambi i recettori sono presenti nelle cellule endocrine α e β del pancreas, nel cuore, nel sistema vascolare, nelle cellule immunitarie (leucociti), nell’intestino e nei reni. I recettori del GIP sono presenti anche sugli adipociti.
Inoltre, entrambi i recettori GIP e GLP-1 sono espressi nelle aree del cervello importanti per la
regolazione dell’appetito. Studi sugli animali dimostrano che tirzepatide si distribuisce e attiva i neuroni nelle regioni del cervello coinvolte nella regolazione dell’appetito e dell’assunzione di cibo. Studi sugli animali dimostrano che tirzepatide può modulare l’utilizzo dei grassi attraverso il recettore GIP. Negli adipociti umani coltivati in vitro, tirzepatide agisce sui recettori del GIP per regolare l’assorbimento del glucosio e modulare l’assorbimento dei lipidi e la lipolisi.
Controllo glicemico
Tirzepatide migliora il controllo glicemico abbassando le concentrazioni glicemiche a digiuno e postprandiali in pazienti con diabete di tipo 2 attraverso diversi meccanismi.
Regolazione dell’appetito e metabolismo energetico
Tirzepatide riduce il peso corporeo e la massa grassa corporea. La riduzione del peso corporeo è dovuta principalmente alla riduzione della massa grassa. I meccanismi associati alla riduzione del peso corporeo e della massa grassa corporea comportano una diminuzione dell’assunzione di cibo attraverso la regolazione dell’appetito. Studi clinici dimostrano che tirzepatide riduce l’apporto energetico e l’appetito aumentando la sensazione di sazietà e pienezza e diminuendo la sensazione di fame. Tirzepatide riduce anche l’intensità del desiderio di cibo e le preferenze per cibi ad alto contenuto di zuccheri e grassi. Tirzepatide modula l’utilizzo dei grassi.
Effetti farmacodinamici
Secrezione dell’insulina
Tirzepatide aumenta la sensibilità al glucosio delle cellule β del pancreas. Migliora la prima e seconda fase della secrezione insulinica in maniera glucosio-dipendente.
In uno studio con iperglicemia mantenuta costante (clamp) in pazienti con diabete di tipo 2, tirzepatide è stata confrontata con il placebo e l’agonista selettivo del recettore GLP-1 semaglutide 1 mg relativamente alla secrezione di insulina. Tirzepatide 15 mg ha aumentato il tasso della prima e della seconda fase della secrezione insulinica rispettivamente del 466 % e del 302 % rispetto al basale. Non vi è stato alcun cambiamento nel tasso della prima e della seconda fase della secrezione insulinica con il placebo.
Sensibilità all’insulina
Tirzepatide migliora la sensibilità all’insulina.
Tirzepatide 15 mg ha migliorato la sensibilità all’insulina dell’intero corpo del 63 %, come misurato dal M-value, una misura dell’assorbimento tissutale del glucosio utilizzando un clamp euglicemico iperinsulinemico. L’M-value è rimasto invariato con il placebo.
Tirzepatide riduce il peso corporeo nei pazienti con obesità e sovrappeso e in pazienti con diabete di tipo 2 (indipendentemente dal peso corporeo), il che può contribuire al miglioramento della sensibilità all’insulina.
Concentrazione del glucagone
Tirzepatide ha ridotto le concentrazioni di glucagone a digiuno e postprandiale in modo glucosio-dipendente. Tirzepatide 15 mg ha ridotto la concentrazione di glucagone a digiuno del 28 % e l’AUC di glucagone dopo un pasto misto del 43 %, rispetto a nessuna variazione con il placebo.
Svuotamento gastrico
Tirzepatide ritarda lo svuotamento gastrico che può rallentare l’assorbimento di glucosio dopo il pasto e può portare a un effetto benefico sulla glicemia postprandiale. Il ritardo nello svuotamento gastrico indotto da tirzepatide diminuisce nel tempo.
Efficacia e sicurezza clinica
Diabete mellito di tipo 2
La sicurezza e l’efficacia di tirzepatide sono state valutate in cinque studi globali randomizzati, controllati, di fase 3 (SURPASS 1-5) che hanno valutato il controllo glicemico come obiettivo primario. Gli studi hanno coinvolto 6 263 pazienti con diabete di tipo 2 (di cui 4 199 trattati con tirzepatide). Gli obiettivi secondari includevano il peso corporeo, la percentuale di pazienti che raggiungevano il target di perdita di peso, la glicemia a digiuno (fasting serum glucose, FSG) e la percentuale di pazienti che raggiungevano il target di emoglobina glicata HbA1c. Tutti e cinque gli studi di fase 3 hanno valutato tirzepatide 5 mg, 10 mg e 15 mg. Tutti i pazienti trattati con tirzepatide hanno iniziato con 2,5 mg per 4 settimane. Quindi la dose di tirzepatide è stata aumentata di 2,5 mg ogni 4 settimane fino al raggiungimento della dose assegnata.
In tutti gli studi, il trattamento con tirzepatide ha dimostrato riduzioni durature, statisticamente significative e clinicamente significative rispetto al basale dell’HbA1c come obiettivo primario rispetto al placebo o al trattamento con un controllo attivo (semaglutide, insulina degludec e insulina glargine) fino a 1 anno. In 1 studio questi effetti sono stati mantenuti fino a 2 anni. Sono state inoltre dimostrate riduzioni del peso corporeo statisticamente significative e clinicamente significative rispetto al basale. I risultati degli studi di fase 3 sono presentati di seguito in base ai dati sul trattamento senza terapia di salvataggio secondo l’analisi dell’intenzione al trattamento modificata (mITT) composta da tutti i pazienti randomizzati che sono stati esposti ad almeno 1 dose del trattamento in studio, esclusi i pazienti che hanno interrotto il trattamento in studio a causa di un arruolamento accidentale.
SURPASS-1 – Monoterapia
In uno studio in doppio cieco controllato con placebo della durata di 40 settimane, 478 pazienti, con controllo glicemico inadeguato con dieta ed esercizio fisico, sono stati randomizzati a ricevere tirzepatide 5 mg, 10 mg o 15 mg una volta a settimana o placebo. I pazienti avevano un’età media di 54 anni e il 52 % erano uomini. Al basale i pazienti avevano una durata media del diabete di 5 anni e l’IMC medio era di 32 kg/m2.
Tabella 2. SURPASS-1: Risultati alla settimana 40

*p < 0,05, **p < 0,001 per superiorità, aggiustato per molteplicità.
†p < 0,05, ††p < 0,001 rispetto al placebo, non aggiustato per molteplicità.
#p < 0,05, ##p < 0,001 rispetto al basale, non aggiustato per molteplicità.

Figura 1. HbA1c (%) media e peso corporeo (kg) medio dal basale alla settimana 40
SURPASS-2 - Terapia di associazione con metformina
In uno studio in aperto di 40 settimane con controllo attivo (in doppio cieco rispetto all’assegnazione della dose di tirzepatide) 1 879 pazienti sono stati randomizzati a ricevere tirzepatide 5 mg, 10 mg o 15 mg una volta a settimana o semaglutide 1 mg una volta a settimana, tutti in associazione con metformina. I pazienti avevano un’età media di 57 anni e il 47 % erano uomini. Al basale i pazienti avevano una durata media del diabete di 9 anni e l’IMC medio era di 34 kg/m2.
Tabella 3. SURPASS2: Risultati alla settimana 40

*p < 0,05, **p < 0,001 for superiorità, aggiustato per molteplicità.
†p < 0,05, ††p < 0,001 rispetto a semaglutide 1 mg, non aggiustato per molteplicità.
#p < 0,05, ##p < 0,001 rispetto al basale, non aggiustato per molteplicità.

Figura 2. HbA1c (%) media e peso corporeo (kg) medio dal basale alla settimana 40
SURPASS-3 – Terapia di associazione con metformina, con o senza SGLT2i
In uno studio in aperto con controllo attivo di 52 settimane, 1 444 pazienti sono stati randomizzati a ricevere tirzepatide 5 mg, 10 mg o 15 mg una volta a settimana o insulina degludec, tutti in associazione con metformina con o senza SGLT2i. Il 32 % dei pazienti utilizzava SGLT2i al basale.
Al basale i pazienti avevano una durata media del diabete di 8 anni, un IMC medio di 34 kg/m2, un’età media di 57 anni e il 56 % erano uomini.
I pazienti trattati con insulina degludec iniziavano con una dose di 10 U/die che è stata aggiustata utilizzando un algoritmo per una glicemia target a digiuno < 5 mmol/L. La dose media di insulina degludec alla settimana 52 era di 49 unità/die.
Tabella 4. SURPASS-3: Risultati alla settimana 52

*p < 0,05, **p < 0,001 per superiorità, aggiustato per molteplicità.
†p < 0,05, ††p < 0,001 rispetto ad insulina degludec, non aggiustato per molteplicità.
#p < 0,05, ##p < 0,001 rispetto al basale, non aggiustato per molteplicità.

Figura 3. HbA1c (%) media e peso corporeo (kg) medio dal basale alla settimana 52
Monitoraggio continuo del glucosio (CGM)
Un sottogruppo di pazienti (N = 243) ha partecipato ad una valutazione dei profili glicemici delle 24 ore acquisiti con un CGM in cieco. A 52 settimane, i pazienti trattati con tirzepatide (10 mg e 15 mg aggregati) hanno trascorso significativamente più tempo con valori di glucosio nell’intervallo euglicemico definito da 71 a 140 mg/dL (da 3,9 a 7,8 mmol/L) rispetto ai pazienti trattati con insulina degludec, rispettivamente con il 73 % e il 48 % del periodo di 24 ore nell’intervallo euglicemico.
SURPASS-4 – Terapia di associazione con 1-3 medicinali antidiabetici orali: metformina, sulfoniluree o SGLT2i
In uno studio in aperto con controllo attivo della durata massima di 104 settimane (misura di esito primaria a 52 settimane), 2 002 pazienti con diabete di tipo 2 e aumentato rischio cardiovascolare sono stati randomizzati a ricevere tirzepatide 5 mg, 10 mg o 15 mg una volta a settimana o insulina glargine una volta al giorno in associazione a metformina (95 %) e/o sulfoniluree (54 %) e/o SGLT2i (25 %). Al basale i pazienti avevano una durata media del diabete di 12 anni, un IMC medio di 33 kg/m2, un’età media di 64 anni e il 63 % erano uomini. I pazienti trattati con insulina glargine hanno iniziato con una dose di 10 U/die che è stata aggiustata utilizzando un algoritmo con un target glicemico a digiuno < 5,6 mmol/L. La dose media di insulina glargine alla settimana 52 era di 44 unità/die.
Tabella 5. SURPASS-4: Risultati alla settimana 52

*p < 0,05, **p < 0,001 per superiorità, aggiustato per molteplicità.
†p < 0,05, ††p < 0,001 rispetto ad insulina glargine, non aggiustato per molteplicità.
#p < 0,05, ##p < 0,001 rispetto al basale, non aggiustato per molteplicità.

Figura 4. HbA1c (%) media e peso corporeo (kg) medio dal basale alla settimana 52
SURPASS-5 - Terapia di associazione con insulina basale titolata, con o senza metformina
In uno studio in doppio cieco controllato con placebo di 40 settimane, 475 pazienti con controllo glicemico inadeguato che utilizzavano insulina glargine con o senza metformina sono stati randomizzati a ricevere tirzepatide 5 mg, 10 mg o 15 mg una volta a settimana o placebo. Le dosi di insulina glargine sono state aggiustate utilizzando un algoritmo con un target glicemico a digiuno < 5,6 mmol/L. Al basale i pazienti avevano una durata media del diabete di 13 anni, un IMC medio di 33 kg/m2, un’età media di 61 anni e il 56 % erano uomini. La dose mediana complessiva stimata di insulina glargine al basale era di 34 unità/die. La dose mediana di insulina glargine alla settimana 40 era di 38, 36, 29 e 59 unità/die rispettivamente con tirzepatide 5 mg, 10 mg, 15 mg e placebo.
Tabella 6. SURPASS-5: Risultati alla settimana 40

*p < 0,05, **p < 0,001 per superiorità, aggiustato per molteplicità.
†p < 0,05, ††p < 0,001 rispetto al placebo, non aggiustato per molteplicità.
#p < 0,05, ##p < 0,001 rispetto al basale, non aggiustato per molteplicità.

Figura 5. HbA1c (%) media e peso corporeo (kg) medio dal basale alla settimana 40
Gestione del peso corporeo
L’efficacia e la sicurezza di tirzepatide per la gestione del peso corporeo, in associazione a una dieta povera di calorie e a un aumento dell’attività fisica, in pazienti con obesità (IMC ≥ 30 kg/m2) o sovrappeso (IMC compreso tra ≥ 27 kg/m2 e < 30 kg/m2) e almeno una comorbidità correlata al peso, (come dislipidemia trattata o non trattata, ipertensione, apnea ostruttiva del sonno o malattia cardiovascolare) e con prediabete o normoglicemia, ma senza diabete mellito di tipo 2, sono state valutate in tre studi di fase 3 randomizzati in doppio cieco, controllati con placebo (SURMOUNT-1, SURMOUNT-3, SURMOUNT-4). In questi studi sono stati inclusi un totale di 3 900 pazienti adulti (2 518 randomizzati a tirzepatide).
Il trattamento con tirzepatide ha dimostrato una riduzione del peso clinicamente significativa e sostenuta rispetto al placebo. Inoltre una percentuale più elevata di pazienti ha ottenuto una perdita di peso ≥ 5 %, ≥ 10 %, ≥ 15 % e ≥ 20 % con tirzepatide rispetto al placebo.
L’efficacia e la sicurezza di tirzepatide per la gestione del peso corporeo in pazienti con diabete di tipo 2 sono state valutate in uno studio di fase 3 randomizzato, in doppio cieco controllato con placebo (SURMOUNT-2) e in una sottopopolazione di pazienti con IMC≥ 27 kg/m2 in cinque studi randomizzati di fase 3 (SURPASS da 1 a 5). Un totale di 6 330 pazienti con IMC ≥ 27 kg/m2 (4 249 randomizzati al trattamento con tirzepatide) sono stati inclusi in questi studi. Nello studio SURMOUNT-2 il trattamento con tirzepatide ha dimostrato una riduzione del peso clinicamente significativa e sostenuta rispetto al placebo. Inoltre, una percentuale più elevata di pazienti ha ottenuto una perdita di peso ≥ 5%, ≥ 10%, ≥ 15% e ≥ 20% con tirzepatide rispetto al placebo. Le analisi dei sottogruppi dei pazienti con obesità o sovrappeso negli studi SURPASS (pari all’86 % della popolazione complessiva degli studi SURPASS da 1 a 5) hanno mostrato una riduzione di peso sostenuta e una percentuale più elevata di pazienti che hanno raggiunto gli obiettivi di riduzione del peso rispetto al comparatore attivo/placebo.
In tutti gli studi SURMOUNT, è stato utilizzato lo stesso schema di aumento della dose di tirzepatide del programma SURPASS (iniziando con 2,5 mg per 4 settimane, seguito da incrementi di 2,5 mg ogni 4 settimane fino al raggiungimento della dose assegnata).
SURMOUNT-1
In uno studio in doppio cieco controllato con placebo della durata di 72 settimane, 2 539 pazienti adulti con obesità (IMC ≥ 30 kg/m2) o con sovrappeso (IMC compresa tra ≥ 27 kg/m2 e < 30 kg/m2) e almeno una condizione di comorbidità correlata al peso, sono stati randomizzati a 5 mg, 10 mg o 15 mg di tirzepatide una volta alla settimana o placebo. A tutti i pazienti è stata consigliata una dieta ipocalorica e una maggiore attività fisica durante tutta la durata dello studio. Al basale, i pazienti avevano un'età media di 45 anni, il 67,5 % era rappresentato da donne e il 40,6 % dei pazienti presentava prediabete. L’IMC medio al basale era 38 kg/m2.
Tabella 7. SURMOUNT-1: Risultati alla settimana 72

††p < 0,001 rispetto al basale.
**p < 0,001 rispetto al placebo, aggiustato per molteplicità.
##p < 0,001 rispetto al placebo, non aggiustato per molteplicità.

Figura 6. Variazione media del peso corporeo (%) dal basale alla settimana 72
Nello studio SURMOUNT-1, le dosi aggregate di tirzepatide 5 mg, 10 mg e 15 mg hanno portato a un miglioramento significativo rispetto al placebo della pressione arteriosa sistolica (-8,1 mmHg vs. - 1,3 mmHg), dei trigliceridi (-27,6 % vs. -6,3 %), del non-HDL-C (-11,3 % vs. -1,8 %), del HDL-C (7,9 % vs. 0,3 %) e dell’insulina a digiuno (-46,9 % vs. -9, 7%).
I pazienti con prediabete al basale hanno continuato il trattamento fino a 176 settimane per valutare gli effetti a lungo termine sul peso corporeo e sull’insorgenza del diabete mellito di tipo 2 confermato all’aggiudicazione.
Tabella 8. SURMOUNT-1: Risultati alla settimana 176 (pazienti con prediabete al basale)
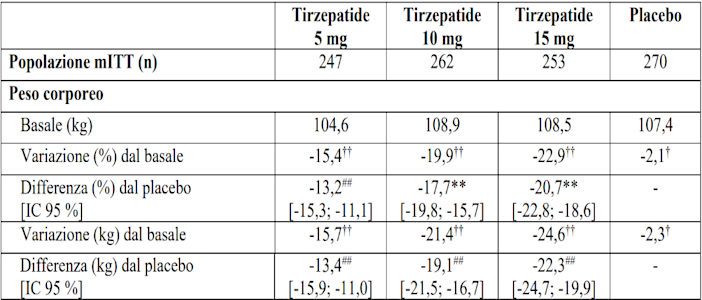
†p < 0,05, ††p < 0,001 rispetto al basale.
**p < 0,001 rispetto al placebo, aggiustato per molteplicità.
##p < 0,001 rispetto al placebo, non aggiustato per molteplicità.
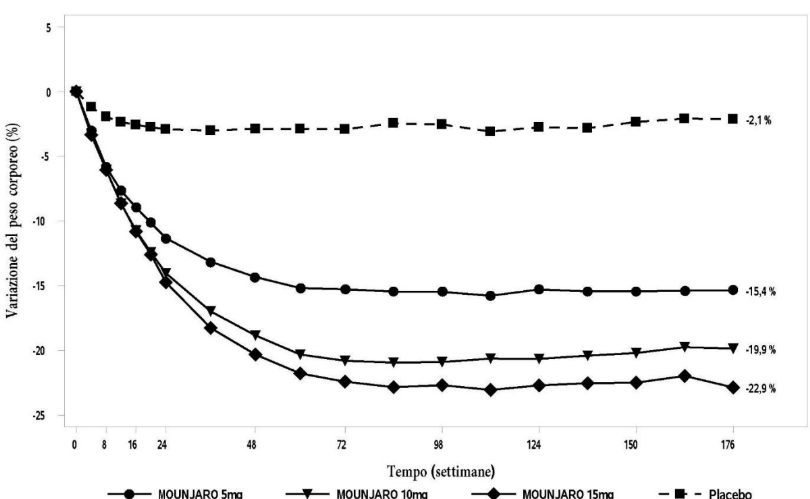
Figura 7. Variazione media del peso corporeo (%) dal basale alla settimana 176 (pazienti con
prediabete al basale)
Tra i pazienti dello studio SURMOUNT-1 con prediabete al basale (N = 1 032), il 95,3 % dei pazienti trattati con tirzepatide è tornato a valori di normoglicemia alla settimana 72, rispetto al 61,9 % dei pazienti nel gruppo placebo. Al termine delle 176 settimane, il 94,5 % dei pazienti trattati con tirzepatide è tornato a valori di normoglicemia, rispetto al 60,4 % dei pazienti nel gruppo placebo, e l’1,2 % dei pazienti trattati con tirzepatide ha sviluppato diabete mellito di tipo 2, rispetto al 12,6 % dei pazienti nel gruppo placebo.
SURMOUNT-2
In uno studio controllato con placebo in doppio cieco di 72 settimane, 938 pazienti adulti con obesità
(IMC ≥ 30 kg/m2) o sovrappeso (IMC ≥ 27 kg/m2 a < 30 kg/m2) e diabete di tipo 2 sono stati randomizzati a tirzepatide 10 mg o 15 mg una volta alla settimana o placebo. I pazienti inclusi nello studio avevano HbA1c 7-10 % e sono stati trattati con dieta ed esercizio fisico da soli o con uno o più agenti poglicemizzanti orali. Tutti i pazienti sono stati assistiti per una dieta a ridotto contenuto calorico e un aumento dell’attività fisica durante tutta la durata dello studio. I pazienti avevano un’età media di 54 anni e il 51 % era rappresentato da donne. L’IMC medio al basale era di 36,1 kg/m2.
Tabella 9. SURMOUNT-2: Risultati alla settimana 72

†p< 0,05 rispetto al basale.
††p < 0,001 rispetto al basale.
**p < 0,001 rispetto al placebo, aggiustato per molteplicità. ##p < 0,001 rispetto al placebo, non aggiustato per molteplicità.

Figura 8. Variazione media del peso corporeo (%) dal basale alla settimana 72
Nello studio SURMOUNT-2, tirzepatide 10 mg e 15 mg (dosi aggregate) hanno portato a un miglioramento significativo rispetto al placebo della pressione arteriosa sistolica (-7,2 mmHg vs. -1,0 mmHg), dei trigliceridi (-28,6 % vs. -5,8 %), del non-HDL-C (-6,6 % vs. 2,3 %) e del HDL-C (8,2 % vs. 1,1 %).
SURMOUNT-3
In uno studio di 84 settimane, 806 pazienti adulti con obesità (IMC ≥ 30 kg/m2) o sovrappeso (IMC ≥ 27 kg/m2 a < 30 kg/m2) e almeno una condizione di comorbidità correlata al peso, sono entrati in un periodo di lead-in di intervento intensivo sullo stile di vita di 12 settimane consistente in una dieta ipocalorica (1 200-1 500 kcal/giorno), aumento dell’attività fisica e frequente consulenza comportamentale. Alla fine del periodo di lead-in di 12 settimane, 579 pazienti che hanno ottenuto una riduzione del peso ≥ 5,0% sono stati randomizzati alla massima dose tollerata (MDT) di tirzepatide di 10 mg o 15 mg una volta alla settimana o a placebo, per 72 settimane (fase in doppio cieco). I pazienti seguivano una dieta a ridotto contenuto calorico e una maggiore attività fisica durante la fase in doppio cieco dello studio. Al momento della randomizzazione, i pazienti avevano un'età media di 46 anni e il 63 % era rappresentato da donne. L’IMC medio alla randomizzazione era di 35,9 kg/m2.
Tabella 10. SURMOUNT-3: Risultati alla settimana 72

1Randomizzazione (settimana 0)
††p < 0,001 rispetto al basale1.
**p < 0,001 rispetto al placebo, aggiustato per molteplicità.
##p < 0,001 rispetto al placebo, non aggiustato per molteplicità.

Figura 9. Variazione media del peso corporeo (%) dalla settimana 12 alla settimana 72
SURMOUNT-4
In uno studio di 88 settimane, 783 pazienti adulti con obesità (IMC ≥ 30 kg/m2) o con sovrappeso (IMC ≥ 27 kg/m2 a < 30 kg/m2) e almeno una condizione di comorbidità correlata al peso, sono stati arruolati in una fase di lead-in con tirzepatide in aperto di 36 settimane. All’inizio del periodo di lead-in, i pazienti arruolati avevano un peso corporeo medio di 107,0 kg e un IMC medio di 38,3 kg/m2. Alla fine del periodo di lead-in, 670 pazienti che hanno raggiunto la massima dose tollerata (MDT) di 10 mg o 15 mg di tirzepatide sono stati randomizzati a continuare il trattamento con tirzepatide una volta alla settimana o a passare al placebo per 52 settimane (fase in doppio cieco). I pazienti sono stati assistiti per una dieta a ridotto contenuto calorico e un aumento dell’attività fisica durante tutta la durata dello studio. Alla randomizzazione (settimana 36), i pazienti avevano un'età media di 49 anni e il 71 % era rappresentato da donne. Il peso corporeo medio alla randomizzazione era di 85,2 kg e l’IMC medio era di 30,5 kg/m2.
I pazienti che hanno continuato il trattamento con tirzepatide per ulteriori 52 settimane (fino a 88 settimane in totale) hanno mantenuto e ottenuto un’ulteriore perdita di peso dopo la riduzione di peso iniziale durante la fase di lead-in di 36 settimane. La riduzione del peso è stata superiore e clinicamente significativa rispetto al gruppo placebo, in cui è stato osservato un sostanziale recupero del peso corporeo perso durante la fase di lead-in (vedere Tabella 11 e Figura 10). Tuttavia, il peso corporeo medio osservato per i pazienti trattati con placebo era inferiore alla settimana 88 rispetto all’inizio la fase di lead-in (vedere Figura 10).
Tabella 11. SURMOUNT-4: Risultati alla settimana 88

††p < 0,001 rispetto al basale.
**p < 0,001 rispetto al placebo, aggiustato per molteplicità. ##p < 0,001 rispetto al placebo, non aggiustato per molteplicità.

Figura 10. Variazione media del peso corporeo (%) dal basale (settimana 0) alla settimana 88
Rischio di recuperare fino a > 95 % del peso basale dello studio (settimana 0) alla settimana 88
L’analisi time to event ha mostrato che il trattamento continuato con tirzepatide durante il periodo in doppio cieco ha ridotto il rischio di tornare a un peso corporeo superiore al 95 % osservato alla settimana 0 di circa il 99 % rispetto al placebo (hazard ratio, 0,013 [IC 95 %, da 0,004 a 0,046]; p < 0,001) per coloro che avevano già perso almeno il 5 % dalla settimana 0.
Effetto sulla composizione corporea
I cambiamenti nella composizione corporea sono stati valutati in un sottostudio nello studio SURMOUNT-1 utilizzando l'assorbimetria a raggi X a doppia energia (DEXA). I risultati della valutazione DEXA hanno mostrato che il trattamento con tirzepatide è stato accompagnato da una maggiore riduzione della massa grassa rispetto alla massa magra, portando a un miglioramento della composizione corporea rispetto al placebo dopo 72 settimane. Inoltre, questa riduzione della massa grassa totale è stata accompagnata da una riduzione del grasso viscerale. Questi risultati suggeriscono che la maggior parte della perdita di peso totale era attribuibile a una riduzione del tessuto adiposo, compreso il grasso viscerale.
Miglioramento del funzionamento fisico
I pazienti con obesità o sovrappeso senza diabete che hanno ricevuto tirzepatide hanno mostrato piccoli miglioramenti nella qualità della vita correlata alla salute, compreso il funzionamento fisico. I miglioramenti sono stati maggiori nei pazienti trattati con tirzepatide rispetto a quelli trattati con placebo. La qualità della vita correlata alla salute è stata valutata utilizzando il questionario generico Short Form 36v2 Health Survey Acute, Version (SF-36v2).
Apnea ostruttiva del sonno
L’efficiacia e la sicurezza di tirzepatide per il trattamento dell’apnea ostruttiva del sonno (OSA) di grado da moderato a severo (Apnea Hypopnea Index, AHI>15), in associazione alla dieta e all’attività fisica, in pazienti con obesità sono state valutate in due studi di fase 3, randomizzati, in doppio cieco, controllati con placebo (Studio 1 e Studio 2 SURMOUNT-OSA). Un totale di 469 pazienti adulti con OSA di grado da moderato a severo e obesità (234 randomizzati a trattamento con tirzepatide) è stato incluso in questi studi. I pazienti con diabete mellito di tipo 2 sono stati esclusi. Lo Studio 1 ha coinvolto pazienti che non erano in grado o non intendevano utilizzare la terapia con pressione positiva delle vie aeree (PAP). Lo Studio 2 ha coinvolto pazienti in terapia con la PAP. Lo Studio 2 non consente alcuna conclusione su un potenziale beneficio aggiuntivo di tirzepatide in aggiunta alla terapia con la PAP, poiché quest’ultima era stata sospesa 7 giorni prima della misurazione dell'endpoint. Tutti i pazienti sono stati trattati con la dose massima tollerata (MDT; 10 mg o 15 mg) di tirzepatide o con placebo, una volta alla settimana per 52 settimane.
In entrambi gli studi, il trattamento con tirzepatide ha dimostrato una riduzione statisticamente significativa e clinicamente significativa dell’indice di apnea-ipopnea (AHI) rispetto al placebo (vedere Tabella 12). Tra i pazienti trattati con tirzepatide, una percentuale maggiore di pazienti ha ottenuto una riduzione dell’AHI di almeno il 50 % rispetto al placebo.
SURMOUNT-OSA, Studio 1 e Studio 2
In due studi di 52 settimane, in doppio cieco, controllati con placebo, 469 pazienti adulti con OSA di grado da moderato a severo e obesità, sono stati randomizzati alla MDT di tirzepatide di 10 mg o 15 mg una volta a settimana, o a placebo, una volta a settimana. Nello Studio 1 i pazienti avevano un’età media di 48 anni, il 33 % era rappresentato da donne, il 35 % aveva OSA moderata, il 63 % aveva OSA severa, il 65 % presentava pre-diabete, il 76 % aveva ipertensione, il 10 % aveva disturbi cardiaci e l’81 % aveva dislipidemia. I pazienti avevano un punteggio medio della Epworth Sleepiness Scale (ESS) di 10,5.
Nello Studio 2 i pazienti avevano un’età media di 52anni, il 28 % era rappresentato da donne, il 31 % aveva OSA moderata, il 68 % aveva OSA severa, il 57 % presentava pre-diabete, il 77 % aveva ipertensione, l’11 % aveva disturbi cardiaci e il 84 % aveva dislipidemia. I pazienti avevano un punteggio medio ESS di 10,0.
Tabella 12. SURMOUNT-OSA, Studio 1 e Studio 2: Risultati alla settimana 52


† p < 0.05, ††p < 0.001 rispetto al basale.
* p < 0.05,**p < 0.001 rispetto al placebo, aggiustato per molteplicità.
a Analizzato utilizzando i dati trasformati nei log.
b La pressione del sangue è stata valutata alla settimana 48 perché la sospensione della terapia con la PAP alla settimana 52 potrebbe confondere la valutazione della pressione arteriosa.
Valutazione cardiovascolare
Il rischio cardiovascolare (CV) è stato valutato tramite una meta-analisi di pazienti con almeno un evento avverso cardiovascolare maggiore (major adverse cardiovascular event, MACE) confermato all’aggiudicazione. La misura di esito composita di MACE-4 includeva morte CV, infarto miocardico non fatale, ictus non fatale o ricovero per angina instabile.
In una meta-analisi primaria degli studi di registrazione di fase 2 e 3 in pazienti con diabete di tipo 2, un totale di 116 pazienti (tirzepatide: 60 [n = 4 410]; tutti i comparatori: 56 [n = 2 169]) hanno avuto almeno un MACE-4 confermato all’aggiudicazione. I risultati hanno mostrato che tirzepatide non era associato a un eccesso di rischio di eventi CV rispetto ai comparatori presi nel loro insieme (HR: 0,81; IC: 0,52-1,26).
Un’ulteriore analisi è stata condotta specificamente per lo studio SURPASS-4 che ha arruolato pazienti con malattia CV accertata. Un totale di 109 pazienti (tirzepatide: 47 [n = 995]; insulina glargine: 62 [n = 1 000]) ha avuto almeno un MACE-4 confermato all’aggiudicazione. I risultati hanno mostrato che tirzepatide non era associato a un eccesso di rischio di eventi CV rispetto a insulina glargine (HR: 0,74; IC: 0,51-1,08).
In 3 studi di fase 3 sulla gestione del peso corporeo (SURMOUNT 1-3), controllati con placebo, un totale di 27 partecipanti ha manifestato almeno un MACE confermato all’aggiudicazione (TZP: 17 (n = 2 806); placebo: 10 (n = 1 250)); il tasso di eventi è stato simile tra placebo e tirzepatide.
Pressione del sangue
Negli studi di fase 3 controllati con placebo in pazienti con diabete mellito di tipo 2, il trattamento con tirzepatide ha determinato una diminuzione media della pressione arteriosa sistolica e diastolica rispettivamente di 6-9 mmHg e 3-4 mmHg. C’è stata una diminuzione media della pressione arteriosa sistolica e diastolica di 2 mmHg ciascuna nei pazienti trattati con placebo.
In 3 studi di fase 3 sulla gestione del peso corporeo (SURMOUNT 1-3), controllati con placebo, il trattamento con tirzepatide ha determinato una diminuzione media della pressione arteriosa sistolica e diastolica rispettivamente di 7 mmHg e 4 mmHg. C'è stata una diminuzione media della pressione arteriosa sistolica e diastolica < 1 mmHg ciascuno nei pazienti trattati con placebo.
Nei due studi di fase 3 sull’OSA, controllati con placebo, con un’analisi aggregata dei dati di sicurezza, il trattamento con tirzepatide ha determinato una diminuzione media della pressione arteriosa sistolica e diastolica rispettivamente di 9 mmHg e 3,8 mmHg alla settimana 52. C'è stata una diminuzione media della pressione arteriosa sistolica e diastolica, rispettivamente, di 2,5 mmHg e 1,0 mmHg nei pazienti trattati con placebo alla settimana 52.
Altre informazioni
Glicemia a digiuno
Negli studi SURPASS da 1 a 5 il trattamento con tirzepatide ha determinato riduzioni significative del FSG rispetto al basale (le variazioni dal basale all’endpoint primario erano da -2,4 mmol/L a - 3,8 mmol/L). Riduzioni significative rispetto al basale del FSG potrebbero essere osservate già a 2 settimane. Un ulteriore miglioramento del FSG è stato osservato fino a 42 settimane, poi è stato mantenuto per tutta la durata dello studio più lungo (104 settimane).
Glicemia postprandiale
Negli studi SURPASS da 1 a 5 il trattamento con tirzepatide ha determinato riduzioni significative della glicemia media post-prandiale a 2 ore (media dei 3 pasti principali della giornata) rispetto al basale (le variazioni dal basale all’endpoint primario sono state da -3,35 mmol/L a -4,85 mmol/L).
Trigliceridi
Negli studi SURPASS da 1 a 5 tirzepatide 5 mg, 10 mg e 15 mg ha determinato una riduzione dei trigliceridi sierici rispettivamente del 15-19 %, 18-27 % e 21-25 %.
Nello studio di 40 settimane di confronto con semaglutide 1 mg, tirzepatide 5 mg, 10 mg e 15 mg ha determinato una riduzione rispettivamente del 19 %, 24 % e 25 % dei livelli sierici di trigliceridi rispetto alla riduzione del 12 % con semaglutide 1 mg.
Nello studio di fase 3 controllato con placebo, della durata di 72 settimane, in pazienti con obesità o sovrappeso senza diabete mellito di tipo 2 (SURMOUNT-1), il trattamento con tirzepatide 5 mg, 10 mg e 15 mg ha determinato una riduzione rispettivamente del 24 %, 27 % e 31 % dei livelli sierici di trigliceridi rispetto alla riduzione del 6 % con placebo.
Nello studio di fase 3 controllato con placebo, della durata di 72 settimane, in pazienti con obesità o sovrappeso con diabete mellito di tipo 2 (SURMOUNT-2), il trattamento con tirzepatide 10 mg e 15 mg ha determinato una riduzione rispettivamente del 27 % e 31 % dei livelli sierici di trigliceridi rispetto alla riduzione del 6 % con placebo.
Percentuale di pazienti che hanno raggiunto HbA1c < 5,7 % senza ipoglicemia clinicamente significativa
Nei 4 studi in cui tirzepatide non è stata associata ad insulina basale (SURPASS da 1 a 4), dal 93,6 % al 100 % dei pazienti che hanno raggiunto una normo-glicemia HbA1c < 5,7 % (≤ 39 mmol/mol) alla misura di esito primaria con il trattamento con tirzepatide, l’hanno raggiunta senza ipoglicemia clinicamente significativa. Nello studio SURPASS-5, l’85,9 % dei pazienti trattati con tirzepatide che hanno raggiunto HbA1c < 5,7 % (≤ 39 mmol/mol) lo ha fatto senza ipoglicemia clinicamente significativa.
Popolazioni speciali
L’efficacia di tirzepatide nel trattamento del diabete mellito di tipo 2 non è stata influenzata da età, genere, popolazione, etnia, regione o da IMC basale, HbA1c, durata del diabete e livello di compromissione della funzione renale.
L'efficacia di tirzepatide nella gestione del peso non è stata influenzata da età, genere, popolazione, etnia, regione, IMC basale e dalla presenza o assenza di prediabete.
L'efficacia di tirzepatide nel trattamento dell’OSA di grado da moderato a severo in pazienti con obesità non è stata influenzata da età, genere, etnia, IMC basale o dalla gravità dell’OSA al basale.
Popolazione pediatrica
L’Agenzia Europea per i medicinali ha rinviato l’obbligo di presentare i risultati degli studi con Mounjaro in uno o più sottogruppi della popolazione pediatrica per il trattamento del diabete mellito di tipo 2 e per la gestione del peso corporeo (vedere paragrafo 4.2 per informazioni sull’uso pediatrico).
5.2 Proprietà farmacocinetiche
Tirzepatide è costituito da 39 aminoacidi e ha una catena di acido grasso C20 attaccata che consente il legame con l’albumina e prolunga l’emivita.
Assorbimento
La concentrazione massima di tirzepatide viene raggiunta da 8 a 72 ore dopo la somministrazione della dose. L’esposizione allo stato stazionario si ottiene dopo 4 settimane di somministrazione una volta a settimana. L’esposizione a tirzepatide aumenta in modo proporzionale alla dose.
Un’esposizione simile è stata ottenuta con la somministrazione sottocutanea di tirzepatide nell’addome, nella coscia o nella parte superiore del braccio.
La biodisponibilità assoluta di tirzepatide sottocutaneo è stata dell’80%.
Distribuzione
Il volume medio apparente di distribuzione di tirzepatide allo stato stazionario dopo somministrazione sottocutanea è circa 10,3 L in pazienti con diabete di tipo 2 e 9,7 L in pazienti con obesità.
Tirzepatide si lega in modo elevato all’albumina plasmatica (99%).
Biotrasformazione
Tirzepatide è metabolizzato dalla scissione proteolitica dello scheletro peptidico, dalla beta ossidazione della porzione della molecola di acido grasso C20 e dall’idrolisi ammidica.
Eliminazione
La clearance media apparente di tirzepatide nella popolazione è circa 0,06 L/h con un’emivita di eliminazione di circa 5 giorni, consentendo una somministrazione una volta a settimana.
Tirzepatide viene eliminato metabolizzato. Le principali vie di escrezione dei metaboliti di tirzepatide sono le urine e le feci. Tirzepatide intatto non è stato osservato nelle urine o nelle feci.
Popolazioni speciali
Età, genere, popolazione, etnia, peso corporeo
Età, genere, popolazione, etnia o peso corporeo non hanno un effetto clinicamente rilevante sulla farmacocinetica di tirzepatide. Sulla base di un'analisi farmacocinetica di popolazione, l’esposizione a tirzepatide aumenta con la diminuzione del peso corporeo; tuttavia, l’effetto del peso corporeo sulla farmacocinetica di tirzepatide non sembra essere clinicamente rilevante.
Compromissione renale
La compromissione renale non influisce sulla farmacocinetica di tirzepatide. La farmacocinetica di tirzepatide dopo una singola dose di 5 mg è stata valutata in pazienti con diversi gradi di compromissione renale (lieve, moderata, severa, ESRD) rispetto a soggetti con funzionalità renale normale e non sono state osservate differenze clinicamente rilevanti. Ciò è stato dimostrato anche per i pazienti con diabete mellito di tipo 2 e compromissione renale sulla base dei dati degli studi clinici.
Compromissione epatica
La compromissione epatica non influisce sulla farmacocinetica di tirzepatide. La farmacocinetica di tirzepatide dopo una singola dose di 5 mg è stata valutata in pazienti con diversi gradi di compromissione epatica (lieve, moderata, severa) rispetto a soggetti con funzionalità epatica normale e non sono state osservate differenze clinicamente rilevanti.
Popolazione pediatrica
Non sono stati condotti studi con tirzepatide in pazienti pediatrici.
5.3 Dati preclinici di sicurezza
I dati preclinici non rivelano rischi particolari per l’uomo sulla base di studi convenzionali di farmacologia di sicurezza, di tossicità a dosi ripetute o di genotossicità.
È stato condotto uno studio di cancerogenicità della durata di 2 anni con tirzepatide in ratti maschi e femmine a dosi di 0,15, 0,50 e 1,5 mg/kg (0,12, 0,36 e 1,02 volte la dose massima raccomandata nell’uomo (maximum recommended human dose, MRHD) basata sull’AUC) dopo somministrazione per iniezione sottocutanea due volte a settimana. Tirzepatide ha causato un aumento dei tumori delle cellule C tiroidee (adenomi e carcinomi) a tutte le dosi rispetto ai controlli. La rilevanza per l’uomo di questi dati non è nota.
In uno studio di cancerogenicità della durata di 6 mesi in topi transgenici rasH2, tirzepatide a dosi di 1, 3 e 10 mg/kg somministrata per iniezione sottocutanea due volte a settimana non ha prodotto un aumento dell’incidenza di iperplasia delle cellule C o di neoplasia della tiroide a qualsiasi dose.
Gli studi sugli animali con tirzepatide non hanno indicato effetti dannosi diretti sulla fertilità.
Negli studi sulla riproduzione animale, tirzepatide ha causato riduzioni della crescita fetale e anomalie fetali a esposizioni inferiori alla MRHD basata sull’AUC. Nei ratti è stata osservata una maggiore incidenza di malformazioni esterne, viscerali e scheletriche e variazioni dello sviluppo viscerale e scheletrico. Sono state osservate riduzioni della crescita fetale nei ratti e nei conigli. Tutti gli effetti sullo sviluppo si sono verificati a dosi tossiche per la madre.
6.1 Elenco degli eccipienti
Penna preriempita monodose; flaconcino monodose
Idrogenofosfato disodico eptaidrato (E339)
Sodio cloruro
Acido cloridrico concentrato (per aggiustare il pH)
Sodio idrossido (per aggiustare il pH)
Acqua per preparazioni iniettabili
Penna preriempita (KwikPen) multidose
Idrogenofosfato disodico eptaidrato (E339)
Alcol benzilico (E1519)
Glicerolo
Fenolo
Sodio cloruro
Acido cloridrico concentrato (per aggiustare il pH)
Sodio idrossido (per aggiustare il pH)
Acqua per preparazioni iniettabili
6.2 Incompatibilità
In assenza di studi di compatibilità, questo medicinale non deve essere miscelato con altri medicinali.
6.3 Periodo di validità
Penna preriempita monodose; flaconcino monodose
Prima dell’uso
2 anni
Mounjaro può essere conservato fuori dal frigorifero fino a un massimo di 21 giorni cumulativi ad una temperatura inferiore a 30 °C e poi la penna preriempita o il flaconcino devono essere eliminati.
Penna preriempita (KwikPen) multidose
Prima dell’uso
2 anni
Dopo il primo utilizzo
30 giorni. Conservare fuori dal frigorifero ad una temperatura inferiore a 30 °C. La penna preriempita KwikPen deve essere eliminata 30 giorni dopo il primo utilizzo.
6.4 Precauzioni particolari per la conservazione
Conservare in frigorifero (2 ºC – 8 ºC).
Non congelare.
Penna preriempita monodose; flaconcino monodose
Conservare nella confezione originale per proteggere il medicinale dalla luce.
Penna preriempita (KwikPen) multidose
Per le condizioni di conservazione dopo il primo utilizzo, vedere paragrafo 6.3.
6.5 Natura e contenuto del contenitore
Penna preriempita monodose
Siringa di vetro racchiusa in una penna preriempita usa e getta.
La penna preriempita ha un ago nascosto che si inserirà automaticamente nella cute quando si preme il pulsante di iniezione.
Ogni penna preriempita contiene 0,5 mL di soluzione.
Confezioni da 2 penne preriempite, 4 penne preriempite e confezione multipla da 12 (3 confezioni da 4) penne preriempite. È possibile che non tutte le confezioni siano commercializzate.
Flaconcino monodose
Flaconcino di vetro trasparente con tappo sigillato.
Ogni flaconcino contiene 0,5 mL di soluzione.
Confezioni da 1 flaconcino, 4 flaconcini, 12 flaconcini, confezione multipla da 4 (4 confezioni da 1) flaconcini o confezione multipla da 12 (12 confezioni da 1) flaconcini. È possibile che non tutte le confezioni siano commercializzate.
Penna preriempita (KwikPen) multidose
Cartuccia di vetro trasparente racchiusa in una penna preriempita multidose.
Ogni penna preriempita contiene 2,4 mL di soluzione iniettabile (4 dosi da 0,6 mL). Ogni penna contiene una quantità in eccesso per il caricamento. Tuttavia, il tentativo di iniettare qualsiasi residuo di medicinale comporterà una dose incompleta, anche se la penna contiene ancora del medicinale. Gli aghi non sono inclusi.
Confezioni da 1 e 3 penne preriempite KwikPen. È possibile che non tutte le confezioni siano
commercializzate.
6.6 Precauzioni particolari per lo smaltimento e la manipolazione
Istruzioni per l’impiego
Ispezionare Mounjaro visivamente prima dell’uso e gettarlo via in caso di presenza di particelle o cambiamento di colore.
Mounjaro non deve essere utilizzato se è stato congelato.
Penna preriempita monodose
La penna preriempita è solo monouso.
Le istruzioni per l’utilizzo della penna, incluse nel foglio illustrativo, devono essere seguite
attentamente.
Flaconcino monodose
Il flaconcino è solo monouso.
Le istruzioni contenute nel foglio illustrativo su come fare l’iniezione di Mounjaro da un flaconcino devono essere seguite attentamente.
Penna preriempita (KwikPen) multidose
La penna preriempita KwikPen è multidose. Ogni KwikPen contiene 4 dosi. Smaltire la penna dopo 4 dosi settimanali.
Le istruzioni per l’utilizzo della KwikPen, incluse nel foglio illustrativo, devono essere seguite
attentamente.
Smaltimento
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente.
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Paesi Bassi.
EU/1/22/1685/001
EU/1/22/1685/002
EU/1/22/1685/003
EU/1/22/1685/004
EU/1/22/1685/005
EU/1/22/1685/006
EU/1/22/1685/007
EU/1/22/1685/008
EU/1/22/1685/009
EU/1/22/1685/010
EU/1/22/1685/011
EU/1/22/1685/012
EU/1/22/1685/013
EU/1/22/1685/014
EU/1/22/1685/015
EU/1/22/1685/016
EU/1/22/1685/017
EU/1/22/1685/018
EU/1/22/1685/019
EU/1/22/1685/020
EU/1/22/1685/021
EU/1/22/1685/022
EU/1/22/1685/023
EU/1/22/1685/024
EU/1/22/1685/025
EU/1/22/1685/026
EU/1/22/1685/027
EU/1/22/1685/028
EU/1/22/1685/029
EU/1/22/1685/030
EU/1/22/1685/031
EU/1/22/1685/032
EU/1/22/1685/033
EU/1/22/1685/034
EU/1/22/1685/035
EU/1/22/1685/036
EU/1/22/1685/037
EU/1/22/1685/038
EU/1/22/1685/039
EU/1/22/1685/040
EU/1/22/1685/041
EU/1/22/1685/042
EU/1/22/1685/043
EU/1/22/1685/044
EU/1/22/1685/045
EU/1/22/1685/046
EU/1/22/1685/047
EU/1/22/1685/048
EU/1/22/1685/049
EU/1/22/1685/050
EU/1/22/1685/051
EU/1/22/1685/052
EU/1/22/1685/053
EU/1/22/1685/054
EU/1/22/1685/055
EU/1/22/1685/056
EU/1/22/1685/057
EU/1/22/1685/058
EU/1/22/1685/059
EU/1/22/1685/060
Data della prima autorizzazione: 15 settembre 2022
24 luglio 2025
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea per i medicinali, https://www.ema.europa.eu
Torna alla home page