Dispositivos de inyección de ▼Omvoh® (mirikizumab)
Dispositivos de inyección de Omvoh® (mirikizumab)
Preguntas frecuentes sobre los dispositivos de ▼Omvoh®
Preguntas relacionadas con el vial de Omvoh®
CONSERVACIÓN DE LOS VIALES SIN ABRIR
Conservar en nevera (entre 2 º C y 8 º C) (vida útil de un vial sin abrir es de 2 años, en su envase original hasta su uso) 1,2
No congelar.
Conservar el vial en el embalaje exterior para protegerlo de la luz.1
CONSERVACIÓN DE VIALES EN USO
Se considera que el vial está en uso a partir del momento en que se pincha por primera vez el tapón del vial. Una vez que el vial está "en uso", debe usarse para preparar la solución diluida.2
El producto debe usarse inmediatamente ya que no contiene conservantes1,2
Si no se utiliza inmediatamente, los tiempos de almacenamiento en uso y las condiciones previas al uso son responsabilidad del usuario y normalmente no serán superiores a 24 horas a una temperatura de entre 2 °C y 8 °C.1
RECOMENDACIONES GENERALES SOBRE LA CONSERVACIÓN DE LA SOLUCIÓN DILUIDA
Mantenga la solución diluida alejada del calor o de la luz directa y en condiciones asépticas. 1
No congele la solución diluida.1
Se recomienda iniciar la infusión inmediatamente después de la dilución.
Si no se utiliza inmediatamente, en la siguiente tabla se explican las condiciones de conservación en función del diluyente utilizado: 3

Referencias
Ficha técnica de Omvoh® (mirikizumab).
Datos de archivo, Eli Lilly and Company y/o una de sus filiales.
Prospecto de Omvoh® (mirikizumab)

Preguntas relacionadas con la pluma precargada de Omvoh®
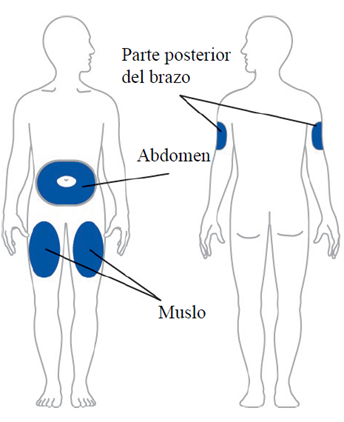
No inyectar a menos de 5 centímetros del ombligo.
El paciente puede inyectar el medicamento en la parte delantera de los muslos. Esta zona debe estar al menos 5 centímetros por encima de la rodilla y 5 centímetros por debajo de la ingle.
Otra persona puede inyectar Omvoh® al paciente en la parte posterior del brazo.
No se debe inyectar en el mismo sitio/lugar cada vez, es recomendable alternar las zonas de inyección.
No se debe inyectar en zonas donde la piel esté dolorida, magullada, roja o dura.
El paciente debe limpiar el lugar de inyección con una toallita con alcohol y dejar que la zona donde se va a inyectar se seque antes de inyectar su medicamento.1
Referencias:
Instrucciones de uso Omvoh® 100 mg solución inyectable en pluma precargada
ANTES DE ADMINISTRAR LA DOSIS EL PACIENTE DEBE TENER EN CUENTA QUE:
Se requieren 2 inyecciones para una dosis completa. El paciente se debe inyectar una pluma inmediatamente seguida de la otra.1
Las plumas deben sacarse de la nevera y dejarse a temperatura ambiente durante 30 minutos antes de la administración.
Los pacientes no las deben calentar en el microondas ni dejar correr agua caliente sobre ellas.
Deben mantenerlas alejadas de la luz solar directa.
Cada pluma de mirikizumab es de un solo uso y no debe compartirse ni reutilizarse.
NO se debe agitar ni usar el medicamento si estaba congelado.
Los pacientes con problemas visuales o auditivos no deben usar la pluma sin la ayuda de otra persona.
El medicamento debe ser transparente. Puede ser incoloro o ligeramente amarillo.
¿CÓMO ADMINISTRAR UNA DOSIS DE LA PLUMA PRECARGADA OMVOH®?
El paciente debe lavarse las manos con agua y jabón antes de inyectarse OMVOH®.
1. Destapar la pluma.1
Asegurarse de que la pluma esté bloqueada (candado en posición cerrada).

Dejar la tapa gris de la base hasta que la dosis esté lista para ser inyectada.
Una vez que el paciente este preparado para recibir la inyección debe desenroscar (girando) la tapa gris de la base.

No volver a colocar la tapa gris de la base – esto podría dañar la aguja.
No tocar la aguja.
2. Colocar y desbloquear.1
El paciente debe colocar la pluma y mantener la base transparente de forma plana y firme sobre su piel.
Luego, deberá girar el anillo de bloqueo que se encuentra en la posición de bloqueo a la posición de desbloqueo (candado verde abierto)
3. Mantener presionado el botón azul de la pluma durante un máximo de 10 segundos, mientras se mantiene la base transparente firme sobre la piel. 1

El paciente escuchará un clic alto (significa que se inició la inyección).
Luego, se escuchará un segundo clic alto unos 10 segundos después de oír el primero (inyección completada).
La inyección se completa cuando el paciente vea el émbolo gris.
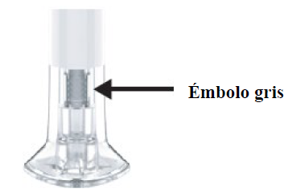
A continuación, el paciente debe retirar la pluma de su piel.
Si hay sangrado en el lugar de la inyección, se debe presionar la zona con un algodón o gasa sobre la zona inyectada.
El paciente no debe frotar el lugar de inyección.
Repetir los pasos anteriores para administrar la segunda pluma.
Referencias
Instrucciones de uso Omvoh® 100 mg solución inyectable en pluma precargada
La aguja de la pluma precargada es,
Estéril.
Hecha de acero inoxidable que contiene níquel.
Lubricada con silicona para mayor comodidad a la hora de la inyección.
Penetra en la piel a una profundidad aproximada de 5,5 mm.
Adherida permanentemente (no se puede quitar), por lo tanto, no funcionará con capuchones de seguridad para agujas.
No es visible ya que la pluma tiene una función de aguja retraíble.
No se debe tocar la aguja. El paciente no debe volver a colocar la tapa gris de la base, ya que podría dañar la aguja.1
Vea la imagen a continuación de la aguja dañada / doblada. Una aguja doblada puede hacer que la pluma precargada no funcione.1

¿LA AGUJA SE RETRAE DESPUÉS DE ADMINISTRAR LA INYECCIÓN?
Cuando el medicamento se administra por completo, la aguja comienza a desplazarse hacia arriba (retraerse). El segundo clic fuerte se escucha justo antes de que la aguja deje de retraerse.1
Si la aguja no se retrae después de la inyección, el paciente no debe tocar la aguja ni volver a colocar la tapa gris de la base. La pluma debe guardarse en un lugar seguro para evitar pinchazos accidentales y el paciente debe ponerse en contacto con su profesional sanitario.1 Póngase en contacto con Lilly para evaluar el caso correspondiente.
Referencias
Datos de archivo, Eli Lilly and Company y/o una de sus filiales.
Instrucciones de uso Omvoh® 100 mg solución inyectable en pluma precargada.
Es normal ver burbujas de aire en las plumas precargadas de mirikizumab. No causarán daño ni afectarán la dosis que reciba el paciente.

El paciente NO debe intentar quitar o expulsar la(s) burbuja(s) de aire de la pluma precargada. La eliminación de las burbujas de aire antes de la inyección no es necesaria y no se recomienda.1
Referencias
Datos de archivo, Eli Lilly and Company y/o una de sus filiales.
Conservar en nevera (entre 2 ºC y 8 ºC).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.1
Los pacientes pueden conservar mirikizumab sin refrigerar hasta 14 días (336 horas) a una temperatura no superior a 30 ºC. No hay límite para el número de exposiciones a temperatura ambiente, siempre y cuando el tiempo total no exceda los 14 días (336 horas) para cada dispositivo. Si se superan estas condiciones, se debe desechar mirikizumab. Esta información es válida exclusivamente para pacientes.1,2
¿QUÉ HACER EN CASO DE EXPOSICIÓN ACCIDENTAL FUERA DE LAS CONDICIONES RECOMENDADAS?
Si mirikizumab se expuso accidentalmente a temperaturas fuera de las condiciones recomendadas, por favor
vuelva a colocar mirikizumab en las condiciones de temperatura recomendadas y,
póngase en contacto con nosotros para una evaluación y determinar si el producto sigue siendo seguro para su uso.
Se le pedirá que proporcione las condiciones de temperatura máxima y/o mínima y el tiempo total de exposición fuera del rango de temperatura aprobado.2
CÓMO INTERPRETAR LA FECHA DE CADUCIDAD DEL ENVASE
Si la fecha de vencimiento en la etiqueta o caja del medicamento está impresa como el mes y el año, el medicamento vencerá el último día de ese mes. El medicamento no debe usarse si ha caducado.2
La vida útil es de mirikizumab es de 2 años.1
Referencias
Ficha técnica de Omvoh® (mirikizumab).
Datos de archivo, Eli Lilly and Company y/o una de sus filiales.

¿QUÉ BOLSAS TÉRMICAS SE RECOMIENDAN PARA VIAJAR?
Eli Lilly and Company no ha probado, ni comercializa, ni vende neveras para mantener mirikizumab frío durante largos períodos de tiempo, por lo que, no podemos hacer una recomendación específica sobre alguna en particular. 2
Si se utiliza una nevera de transporte de viaje, el paciente debe asegurarse de que mirikizumab no entre en contacto con el hielo o las bolsas de gel congeladas ni con temperaturas bajo cero.
El medicamento siempre debe protegerse de la luz.2
VIAJES INTERNACIONALES
Los pacientes que viajan al extranjero deben consultar con las autoridades del país que planean visitar (embajada). Esto se aplica especialmente a los viajes fuera de la Unión Europea. 2
Referencias
Ficha técnica de Omvoh® (mirikizumab).
Datos de archivo, Eli Lilly and Company y/o una de sus filiales.
El paciente debe colocar la pluma usada en un contenedor de eliminación de objetos punzantes inmediatamente después de su uso, según normativa local. 1
No colocar los dispositivos en la basura doméstica.
No reciclar el contenedor de eliminación de objetos punzantes usados.
Si el paciente no dispone de un contenedor para desechar objetos punzantes, puede usar un recipiente doméstico que sea:
– de plástico resistente,
– pueda cerrarse con una tapa hermética, resistente a los pinchazos, sin que puedan salir objetos cortantes,
– vertical y estable durante el uso,
– resistente a fugas,
– debidamente etiquetado para advertir de la presencia de residuos peligrosos en el interior del contenedor. 1
Estas indicaciones son válidas incluso si el producto no ha sido utilizado. 2
Referencias
Instrucciones de uso Omvoh® 100 mg solución inyectable en pluma precargada.
Datos de archivo, Eli Lilly and Company y/o de sus subsidiarias.
Preguntas relativas a ambos dispositivos de Omvoh®
CARACTERÍSTICAS QUÍMICAS Y FÍSICAS
Apariencia: El concentrado debe ser transparente, de incoloro a ligeramente amarillo y sin partículas visibles.1
Densidad a 20°C :
Vial: 1.0062 g/mL.
Dispositivos: (plumas/jeringas precargadas): 1.0058 g/mL.2
pH: aproximadamente es 5,5.1
pI (punto isoeléctrico): El pH en el que la carga neta de mirikizumab es cero, es 7,4 (medido).2
Gravedad específica:
Vial: 1.0062 g/mL.
Plumas precargadas: 1,0058 g/mL 2
Osmolaridad: aproximadamente es 300 mOsm/L.1
Referencias
Ficha técnica de Omvoh® (mirikizumab).
Datos de archivo, Eli Lilly and Company y/o de sus subsidiarias.
No se utilizan componentes que contengan látex para fabricar los dispositivos de mirikizumab (viales y plumas precargadas). Los dispositivos están fabricados con componentes de metal, vidrio y plástico.1
Referencias
Datos de archivo, Eli Lilly and Company y/o de sus subsidiarias.